با توجه به تغییر کتاب شیمی 3 دانش آموزان عزیز می توانند آنرا از لینک زیر دریافت کنند
برای دانلود کلیک کنید
![]()
منبع:(( وبلاگ شیمی خرامه ))
آماده سازي مجدد :علی حیدري جابري

با توجه به تغییر کتاب شیمی 3 دانش آموزان عزیز می توانند آنرا از لینک زیر دریافت کنند
برای دانلود کلیک کنید
![]()
منبع:(( وبلاگ شیمی خرامه ))
آماده سازي مجدد :علی حیدري جابري

انواع واکنش های شیمیایی
واکنش سوختن: واکنشی که در آن یک ماده به شدت با اکسیژن واکنش داده ، نور و گرما و ترکیبات اکسیژن دار تولید میکند.
انواع واکنش های سوختن
1. سوختن هیدروژن و هیدروکربن ها مثل متان و نفت و بنزین
2. سوختن بسیاری از نافلزات مثل کربن(C) و گوگرد (S) و فسفر(P)
3. سوختن فلزات فعالی چون فلزات قلیایی و قلیایی خاکی به جز برلیم(Be)
بقیه در ادامه مطلب........
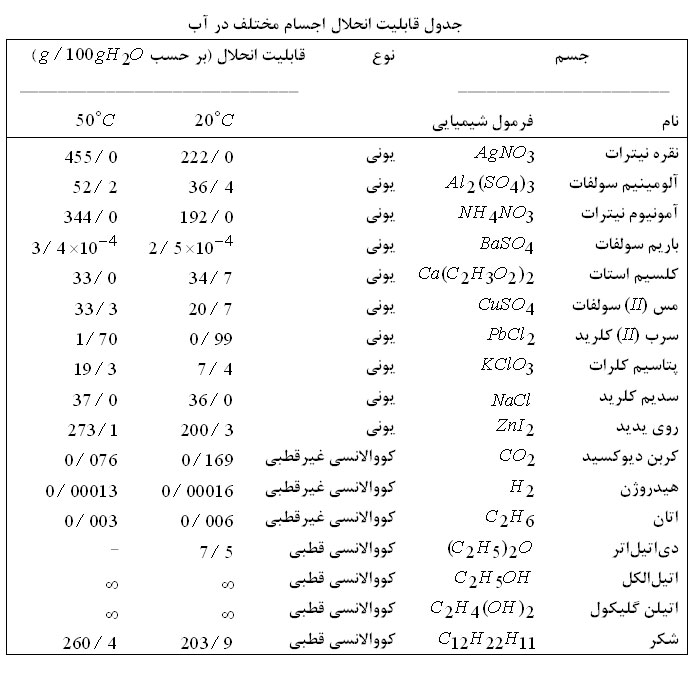

برای محلول مایع در مایع با حل شونده فرار فشار بخار کل برابر با مجموع فشار
جزئی حلال و حل شونده است ولی وقتی حل شونده غیر فرار باشد فشار بخار
آنقدر ناچیز است که می توان گفت فشار بخار محلول فقط مربوط به حلال است
P = XA . P0A کل
P =( 1 - XB) . P0A کل
A نقش حلال و B نقش حل شونده دارد در چنین محلولی فشار بخار محلول
کمتر از فشار بخار حلال خالص در همان دما خواهد بود زیرا در حالت محلول بخشی
از سطح آزاد مایع در اشغال مولکول هایحل شونده قرار میگیرد و چون تبخیر از
سطحصورت می گیرد در چنین حالتی فرار مولکولهای حلال به فاز بخار ( تبخیر
سطحی ) کاهش می یابد
بنابراین تراکم ذرات بخار در فاز بخار کمتر می گردد
وچون فشار یکگازباعده ذرات نسبت مستقیم دارد می توان گفت در حالت
محلول چون تراکم ذرات بخار کاهش می یابد این ذرات فشار ضعیفتری
اعمال میکنند یعنی فشار بخار محلول در هر دمائی از فشار بخار ماده
خالص کمتر است
در این شرایط این که ماده حل شونده چه باشد اهمیتی ندارد و تعدادذرات
ماده حل شده در مقدار معینی از حلال است کهمقدار کاهش فشار بخار را
تعیین می کند به خواصی از یک محلول که به نوع ذرات حل شونده بستگی
نداشته و تنها وابسته به عده ذرات حل شونده است خواص کولیگاتیومی گویند
انحلال حل شونده غیر فرار در یک حلال علاوه بر فشار بخار دمای جوش ودمای
انجماد آن را نیز تغییر می دهدوقتی به یک نمونه مایع حرارت میدهیم دمای آن
لحظه به لحظه افزایش می یابد ذرات مایع پر جنب وجوش ترو پر انرژی ترمی شوند
در این شرایط ذرات مایع راحت تر به نیروی جاذبهمولکول همسایه غلبه کرده وبه فاز
بخار می روند پس با افزایشدما تراکم ذرات بخار بر سطح آزاد مایع افزایش یافته و
فشارقوی تری اعمال میکنند چنانچه از نمودار فوق نیز روشن است با افزایش دما
فشار بخار بیشتر می شود ولی حالت قلیان و جوششزمانی بوجود می آید که
فشار بخار مایع با فشار بخار محیط برابر شود به عبارت بهترچون بر روی سطح آزاد
مایع فشار هوا ، فشار وارد میکند پس برای آنکه یک مایع به جوش آید باید بتوان
هوای بالای خود راپس بزند و این در صورتی امکان پذیر است که فشار بخار مایع
بافشار بخار محیط برابر شودنقطه جوش یک مایع برحسب تعریف دمایی است که
در آن دمافشار بخار مایع با فشار بخار جو برابر می شود. چون افزایشیک ماده حل
شونده غیر فرار موجب کاهش فشار بخار یک مایع میشود بنابراین محلول در نقطه
جوش نرمال حلال خالص نمی جوشد به بیان کامل تر چون فشار بخار محلول کمتر از
فشار بخار مایع خالص است در دمای بالاتری با فشار بخار محیط برابر میشود و دمای
جوش محلولهمواره بالاتر از نقطه جوش حلال خالص است.
نمودارزیر این مطلب را به خوبی نمایش می دهد قابل دقت است که این نمودار با اندازه
های واقعی رسم نشده است وتنها برای چگونگی تغییرات ترسیم گردیده است
¥Tb برابر اختلاف دمای جوش محلول و دمای جوش حلال خالص است
جامدات نیز مانند مایعات فشار اعمال میکنند که به آن فشار بخار جامد میگوئیم که
مقدار این فشا در مقایسه با فشار بخار مایع بسیار کم استدرنقطه انجماد ،فشاربخار
جامد برابر فشار بخار حلال است . به عبارت بهتر منحنی های فشار بخار حلال مایع و
فشار بخار حلال جامد یکدیگر را در نقطه انجماد حلال قطع میکنند . اما چون فشار بخار
محلولپائین تر از فشار بخار تعادلی حلال خالص است منحنی فشاربخارمحلول،منحنی
فشار بخار حلال جامد را دمای پائین تری قطع میکند . از این رو دمای انجماد در محلول
ها پائین تر از دمای انجماددر حلال خالص است .
¥Tf برابر اختلاف دمای انجمادمحلول و دمای انجماد حلال خالص است ناگفته نماند
کاهش دمای انجماد در محلولها نیز به نوع مادهحل شونده بستگی ندارد وتنها وابسته
به عده ذرات حل شونده است بنابراین در زمره خواص کولیگاتیو قرار می گیردبنابراین
اساس انتظار میرود برای محلول های 1 مولال از محلول های مختلف
میزان کاهش دمای انجماد یا افزایش دمای جوش به یک اندازه باشد ولی محلول-
های الکتروایت کمی متفاوت عمل میکنند به طور مثال نزول نقطه انجماد
درمحلولهای1 مولال از نمک طعام ( NaCl ) یا نقره نیترات ( AgNO3 ) تقریبا 2 برابر
نزول نقطه انجماد در محلول های غیر الکترولیت ( مانند شکر ) با همان غلظت است .
علت این است که الکترولیت ها در محلول به یونهای مربوطه تفکیک میشوند مثلا
NaClبه یونهای- Cl و+ Na نقره نیترات + Ag و- NO3 تفکیک میشوندیعنی از هرذره، دو
ذره حاصل میشود در نتیجه دو برابر یک محلول غیر الکترولیت مانند شکر دمای انجماد
را کاهش ویا دمای جوش را افزایش می دهند و به همین ترتیب میزان صعود نقطه
جوش وکاهش دمای انجماد در محلولهایی مانند K2SO4 و BaCl2 که به ازای هر
مولکول 3 ذره تولید میکنند 3 برابر یک محلول غیر الکترولیت مانند شکر یا الکل است
برای الکترولیت های ضعیف تفکیک یونی کامل صورت نمی گیرد و فرایند یونیده شدن
آنها برگشت پذیر است . در چنین محلولی ، مولکولها مدام به یون تفکیک میشوند
ولی یونها با همان سرعت مجددا به یکدیگر برخورد کرده ومولکولها را بوجود می آورند
به طور مثال در محلول آمونیوم ئیدروکسید 1 مولال کاهش دمای انجماد و افزایش دمای
جوش از محلول یک مولال شکر بیشتر است چون این محلول تا حد کمی تفکیک
میشود و به هر حال عده ذرات آن، از عده ذرات در محلول 1 مولال آب وشکر بیشتر
است ولی چون تفکیک صددر صد ندارند کمتر از محلول نمک طعام دمای انجماد را
کاهش می دهند
انرژی آزاد گیبس :
اثر 3 عامل آنتالپی، آنتروپی و دما برجهت انجام یک فرایند با کمیتی به نام انرژی آزاد گیبس نشان داده می شود. انرزی ازاد گیبس کمیتی است که مقدار نیروی پیشران یک فرایند را نشان میدهد واز این رابطه محاسبه می شود
انرژی آزاد گیبس نیز تابع حالت است از این رو می توان نوشت:
آغازیG - پایانی G = ∆G
∆G نتیجه عملکرد آنتالپی و آنتروپی را نشان میدهد
* اگر ∆G منفی باشد واکنش خودبخودی است
* اگر ∆G مثبت باشد واکنش غیرخودبخودی است
نتیجه بالا با نتیجه بدست آمده از بررسی عوامل آنتالپی و آنتروپی کاملا هماهنگ است یک بار دیگر 4 حالت واکنشها را مورد بررسی قرار می دهیم. نتیجه این بررسی در جدول زیر خلاصه شده است. قابل دقت است در این جدول عبارت∆G = ∆H - T∆S بصورت
نمایش داده شده است .دما T بر حسب کلوین بوده و همیشه مثبت است
پیش بینی جهت پیشرفت واکنش :
آنتالپی و آنتروپی یک سامانه در طی یک انجام یک فرایند شیمیایی یا فیزیکی دستخوش تغییر میشوند و تمایل سامانه ها برای دستیابی به حداقل آنتـالپی و حداکثر آنتـروپی جهت پیشرفت یک فرایند را تعیین می کند. به طور معمول در رخدادهای فیزیکی و شیمیایی یکی از حالت های زیر وجود دارد
1)فرایندهایی که در آنها ∆H < 0 و S > 0 ∆ است
در این نوع واکنش ها هم عامل آنتالپی و هم عامل آنتروپی به صورت مساعد عمل کرده و موجب پیشرفت واکنش می شوند به عبارت بهتر هیچ عاملی جلوی انجام واکنش را نگرفته و موجب هدایت آن به سمت چپ نمیگردد بنابراین روند عکس این فرایندها هرگز صورت نگرفته و این واکنشها یک طرفه هستند
طور مثال فرایند سوختن الکل فقط در مسیر رفت در هر شرایطی خودبخودی است و نمی توان از ترکیب آب و کربن دی اکسید دوباره الکل و اکسیژن ساخت.

بقیه در ادامه مطلب........
قانون اول ترمودینامیک راههای انتقال انرژی را در طی یک فرایند شیمیایی یا فیزیکی مورد بررسی قرار می دهد و به جهت انجام فرایندهای شیمیایی یا فیزیکی نمی پردازد. برخی از تحولات در هر شرایطی قابلیت انجام دارند و در هر شرایطی خودبخودی اند در حالیکه برخی دیگر از فرایندها در شرایط خاصی خودبخودی و در شرایطی دیگر غیر خودبخودی اندمنظور از یک تحول خود بخودی تحولی است که در شرایط خاصی از نظر دما و فشار بتواند به طور طبیعی صورت بگیرد به طور مثال در دمای بالاتر از صفر درجه ذوب یخ یک فرایند خودبخودی است روند عکس یعنی انجماد آب در این دما غیر خودبخودی است
به طور کلی در جهت پیشرفت خود بخودی یک واکنش دو عامل موثرند:
1 ) انرژی (آنتالپی
2) بی نظمی (آنتروپی)
بقیه در ادامه مطلب........

بقیه در ادامه مطلب........

این ترانه ی شیمیایی ! با شعری برگرفته از نام 102 عنصر و با اجرای پیانو ساخته شده است . ترتیب نام این عنصرها بر اساس میزان ( وزن ) موسیقی ( و نه بر اساس ترتیبشان در جدول تناوبی ) می باشد . این ترانه در سال 1959 به وسیله ی تام لهرر اجرا شده است . لهرر که مدرس ریاضیات دانشگاه هاروارد بوده است ، این ترانه را با صدای خود خوانده است . تا به امروز کلیپ های مختلفی از این ترانه ساخته شده است که یکی از این کلیپ ها را در اختیار شما قرار می دهم . امیدوارم از مشاهده ی آن لذت ببرید .


ایروژل (AeroGel) ماده ای به سبکی هوا
آیروژل سبک ترین ماده جامد شناخته شده در جهان است که چگالی اش تنها سه برابر هواست. در آزمایشگاه ها ساخته میشود و در بین تمام جامدات کمترین چگالی را دارد.
آیروژل در سال 1931 توسط "استیون کیستلر"، یکی از پژوهشگران دانشگاه استنفورد ایالات متحده کشف گردید و گاهاً به دلیل شکل ظاهری اش آن را "دود منجمد" نیز می نامند.
هر چند قطعه ای از ایروژل به ابعاد یک انسان تنها 0.5 گرم وزن خواهد داشت، ساختار درونی آن به گونه ای است که قادر است وزن یک اتومبیل کوچک را تحمل کند! ویژگی منحصر بفردش در خصوص عایق گرمایی موجب شد تا مسئولین ناسا آن را برای جلوگیری از یخ زدگی روبات سوئجرنر در شب های مریخ، به کار ببرند. به علاوه این ماده برای جمع آوری مواد سرگردان موجود در فضا بسیار ایده آل است و در جریان مأموریت "استارداست" از آن برای جذب مواد موجود در هاله پیرامون دنباله دار وایلد-2 استفاده شد.

کاوندیش فیزیکدان و شیمیدان انگلیسی در شهر نیس فرانسه به دنیا آمد زیرا مادرش که از بیماری رنج می برد به مناطق خوش آب و هوای آنجا آمده بود. او در انگلستان به تحصیل پرداخت.
کاوندیش تنها به پژوهش های علمی عشق می ورزید و مدت شصت سال در آزمایشگاه خود مشغول به کار و کوشش بود.
نتیجه این مدت تلاش او بسیار ارجمند و گرانبهاست. او کسی است که مشخص کرد که از سوختن هیدروژن آب تولید می شود و آب ماده ای مرکب است. مهمترین کار کاوندیش محاسبه جرم زمین است و بزرگدانی قدردانی از او تاسیس آزمایشگاهی است که در لندن به احترام او نامگذاری شده است.
از دیگر آثار علمی کاوندیش می توان به اندازه گیری وزن حجمی اتم ها اشاره کرد. او همچنین نشان داد که هیدروژن سبکترین گازها است. همچنین چگالی متوسط زمین را برابر 5/5 گرم بر سانتی متر مکعب به دست آورد.

کانی شناس و داروشناس جهان اسلام و یکی از بزرگترین دانشمندان اسلام است که با ریاضیات ، نجوم ، فیزیک ، کانی شناسی ، دارو سازی و اغلب زبانهای زنده زمان خود آشنایی داشته است. یکی از آثار مهمبیرونی در شیمی ، کتاب الجواهر وی است که در بخشی از آن ، نتایج تجربی مربوطه به تعیین جرم حجمی امروزی آنها تفاوت خیلی کم دارد و یکی از کاربردهای مهم وی به شمار میرود که در علوم تجربی ، انقلابی بزرگ بوجود آورد. وی برای تعیین جرم اجسام ، ترازویی ابداع کرد
بیرونی همچنین در کتاب الجماهیر (در شناسایی جوهرها) به معرفی مواد کانی ، بویژه جواهرات گوناگون پرداخت. بیرونی ، چگالیسنج را برای تعیین جرم حجمی کانیها بویژه جوهرها و فلزها نوآوری کرد که در آزمایشگاه امروزی کاربرد دارد

ابن سینا ملقب به شیخ الرئیس ، بزرگترین فیلسوف و دانشمند اسلامی و چهره ای بسیار موثر در میدان علوم و فنون است. غربیها وی را به نام اوسینیا میشناسند. ابن سینا ، رنجی برای کیمیاگری و ساختن طلا نکشید؛ زیرا او به استحاله باور نداشت و صریحا تبدیل فلزات به یکدیگر را ناممکن و غیر عملی میدانست.
ابو علی سینا از ادویه منفرد ، 785 قلم دارو را به ترتیب حروف ابجد نام برده ، به ذکر ماهیت آنها پرداخته ، خواص تاثیر آن داروها را شرح داد. وی ضمن توصیف این مواد ، آگاهیهای جالبی در زمینه «شیمی کانی» به خوانندگان میدهد و میگوید از ترکیبگوگرد و جیوه ، میتوان شنگرف تهیه کرد. وی نخستین کسی است که خواص شیمیایی الکل و اسید سولفوریک را از نظر دارویی شرح داد.

زکریای رازی بهعنوان یکی از بزرگترین حکیمان مسلمان شناخته شده ، غربیها او را به نام رازسمیشناسند. رازی در علم کیمیا ، روش علمی محض را انتخاب کرده ، بر خلاف روشهای تمثیلی و متافیزیک ، به روشهای علمی ارزش زیادی قائل شده است. رازی ، موسس علم شیمی جدید و نخستین کسی است که «زیست شیمی» را پایهگذاری نموده است. دکتر روسکا ، شیمیدان آلمانی گفته است: «رازی برای اولین بار مکتب جدیدی در علم کیمیا بوجود آورده است که آن را مکتب علم شیمی تجربی و علمی میتوان نامید. مطلبی که قابل انکار نیست، اینست که زکریای رازی ، پدر علم شیمی بوده است.»
کتابهای او در زمینه کیمیا در واقع ، اولین کتابهای شیمی است. مهمترین اثر رازی در زمینه کیمیا کتاب «سرالاسرار» است. ظاهرا رازی ، 24 کتاب یا رساله در علم کیمیا نوشته است که متاسفانه فقط معدودی از آنها بدست آمده است و در کتابخانههای مشهور دنیا نگهداری میشود. وی نخستین بار ازتقطیر شراب در قرع و انبیق مادهای بدست آورد که آن را الکحل نامید که بعدها به هر نوع ماده پودری شکل حتی به جوهر هم داده شد، از این رو آن جوهر را جوهر شراب نیز نامیدند. گفته میشود که رازی کربنات آمونیوم را از نشادر و همچنین کربنات سدیم را تهیه کرده است.

جابر بن حیان معروف به صوفی یا کوفی ، کیمیاگر ایرانی بود و در قرن نهم میلادی میزیست و بنا به نظریه اکثریت قریب به اتفاق کیمیاگران اسلامی ، وی سرآمد کیمیاگران اسلامی قلمداد میشود. شهرت جابر ، تنها به جهان اسلام محدود نمیشود و غربیها او را تحت عنوان «گبر» میشناسند. "ابن خلدون" درباره جابر گفته است:
جابربن حیان پیشوای تدوین کنندگان فن کیمیاگری است
.
جابر بن حیان ، کتابی مشتمل بر هزار برگ و متضمن 500 رساله ، تالیف کرده است. "برتلو" شیمیدان فرانسوی که به پدر شیمی سنتز مشهور است، سخت تحت تاثیر جابر واقع شده ، میگوید: «جابر در علم شیمی همان مقام و پایه را داشت که ارسطو در منطق.» "جورج سارتون" میگوید: «جابر را باید بزرگترین دانشمند در صحنه علوم در قرون وسطی دانست.» "اریک جان هولیمارد" ، خاورشناس انگلیسی که تخصص وافری در پژوهشهای تاریخی درباره جابر دارد، چنین مینویسد:
««جابر ، شاگرد و دوست امام صادق علیهالسلام بود و امام را شخصی والا و مهربان یافت؛ بطوریکه نمیتوانست از او جدا ولی بینیاز بماند. جابر میکوشید تا با راهنمایی استادش ، علم شیمی را از بند افسانههای کهن مکاتب اسکندریه برهاند و در این کار تا اندازهای به هدف خود رسید.»»
برخی از کتابهایی که جابر در زمینه شیمی نوشته عبارتند از : الزیبق ، نارالحجر ، خواص اکسیرالذهب ، الخواص ، الریاض و ... .
وی به آزمایش بسیار علاقمند بود. از این رو ، میتوان گفت که نخستین دانشمند اسلامی است که علم شیمی را بر پایه آزمایش بنا نهاد. جابر نخستین کسی است که اسید سولفوریک یا گوگرد را از تکلیس زاج سبز و حل گازهای حاصل در آب بدست آورد و آن را زینت الزاج نامید. جابر ، اسید نیتریک یا جوهر شوره را نیز نخستین بار از تقطیر آمیزه ای از زاج سبز ، نیترات پتاسیم و زاج سفید بدست آورد.
داوی :
در سال 1800 با استفاده از سیل ولتا ، پدیده الکترولیز را کشف و با ارائه نظریه الکترو شیمیایی خود خاصیت الکتریکی مواد و ماهیت پیوند شیمیایی را که بر اساس نظریه اتمی دالتون معین شده بود مشخص کرد و با الکترولیز قلیایی ، فلزات قلیایی را تهیه کرد که سود و پتاس عنصر نیستند بلکه سدیم و پتاسیم جزو عنصرها بوده ، سود و پتاس موادی مرکباند.
بقیه در ادامه مطلب ........
دیدکلی
این گازها از مخلوط شدن گازهای گوناگون مانند CO2 ، He ، H2S ، N2 با تشکیل میشوند. هیدروکربنها معمولا ازنوع متان و دیگر پارافینهای ردیف پایین هستند. و ، ترکیبات گاز در فازهای مختلف را معین میسازد. درنتیجه کاهش فشار ، اکثر هیدروکربنهای ردیف بالا تغییرحالت میدهند، یعنی گازهای مرطوب درست میشوند. درصورتی که تمام گازهای خشک تقریبا از متان درست میشوند.
بقیه در ادامه مطلب ........
آیا امکان دارد یخ بسوزد. آزمایش می کنیم ببینیم می شود یا نه عجله نکنید.
مواد مورد نیاز:
300 سی سی الکل اتیلیک
12 گرم استات کلسیم که باید در 40 سی سی آب حل شود.
یک بشر را برداشته و در آن استات کلسیم می ریزید و در بشر دیگر الکل اتیلیک را ریخته. حالا این دو ماده را با همدیگر ترکیب کرده و یک ماده جدید حاصل می شود که حالت کلوییدی دارد و این همان الکل جامد می باشد. و حالا می دانیم که الکل قابل احتراق می باشد. پس آتش بزنیدش.

بعضی وقت ها در فیلم ها یا در یک نمایش شعبده بازی دیده اید که یک نفر دست خود را روی آتش می گیرد و نمی سوزد. اما مگر امکان دارد. بله این امکان هست و قصد دارم برای شما توضیح دهم.
موادی که برای این کار لازم دارید:
60 سی سی سولفید کربن
40 سی سی تتراکلرید کربن
ابتدا این دو ماده را باهمدیگر مخلوط کرده و در کف دست خود بریزید و سپس شعله آتش را به کف دست خود نزدیک کرده تا آتش بگیرد. ولی دست شما نمی سوزد زیرا آتش سرد می باشد ولی کمی احساس سوزش دارید. زمانی که شما این دو ماده را با همدیگر مخلوط می کنید ماده حاصل شده دارای نقطه ذوب بسیار پایین می باشد.
چند نکته آزمایشگاهی:
یک دو قطره از این مخلوط را در کف دست خود بریزید.
زمانی که قصد انجام آزمایش را دارید در همان لحظه این دو ماده را با همدیگر مخلوط کنید.
این آزمایش را در یک اتاق تاریک انجام دهید.
|
بخش اول |
|
واکنشهای شیمیایی را می توان به صورت معادله هایی نوشت و در آن از نمادهای شیمیایی عنصرها برای نمایش دادن آنها استفاده کرد. بر طبق قانون پایستگی جرم تعداد اتمهای هر عنصر باید در دو طرف معادله یکسان باشد یعنی معادله باید موازنه باشد. بقیه در ادامه مطلب ........ |
برای مشاهده ویدیو آموزشی کلیک کنید

این هم یک ویدیو آموزشی امیدوارم که موجب ضایت خاطر شما بشود.
منبع سایت آپارات
آزمايش آسمان آبي

ظرف شيشه اي را از آب پر كنيد و منبع نور را (مانند شكل زير) طوري قرار دهيد كه پرتوهاي نور از ظزف آب بگذرند. شير خشك را كم كم به آب اضافه كنيد و آن را به هم بزنيد. تا زماني كه بتوانيد شعاعهاي نور را ببينيد. همانند شكل يكبار از كنار و بار ديگر از انتها به ظرف نگاه كنيد. شما همچنين ميتوانيد صفحه مقوايي را در انتهاي ظرف ، جايي كه نور به آن بتابد نگاه داريد. از كنار ظرف رنگ شعاعها سفيد مايل به آبي به نظر ميرسند ولي از انتهاي ظرف ، زرد - نارنجي ديده ميشوند. اگر به اندازه كافي به آب شير اضافه كرده باشيد، ميتوانيد تغيير رنگ شعاع نور از آبي - سفيد به زرد - نارنجي را در طول شعاع ببينيد.
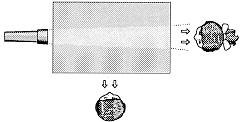
چه اتفاقي در حال وقوع است؟
اگر ميخواهيد از يك شعاع نور باريك استفاده كنيد، به كمك يك منگنه ، سوراخي در يك اسلايد سياه يا فيلم عكاسي 35 ميليمتري يا كارت مقوايي ايجاد كنيد. اسلايد ، فيلم يا كارت مقوايي را در پروژكتور قرار دهيد (در كنار عدسي نگذاريد). پروژكتور را تنظيم كنيد تا يك پرتو نور باريك بدست آوريد.
خورشيد توليد كننده نور سفيد است. اين نور سفيد از همه رنگها تشكيل يافته است: قرمز ، نارنجي ، زرد ، سبز ، آبي ، نيلي ، بنفش. نور موج است و هر كدام از رنگها به يك فركانس معين و در نتيجه به يك طول موج معين از نور مربوط ميباشد. رنگها در رنگين كمان بر اساس فركانس ترتيب يافتهاند: نور بنفش ، نيلي و آبي، از نورهاي قرمز، نارنجي و زرد، فركانس بالاتري دارند.
وقتي نور خورشيد از اتمسفر زمين مي گذرد و با مولكول هاي گازهاي درون جو برخورد مي كند، پراكنده مي شود. هر چقدر طول موج نور كوتاهتر باشد، بيشتر توسط اتمسفر پراكنده ميشود، بدليل اين كه طول موج نور آبي از طول موج نور قرمز بزرگتر است، حدود 10 برابر بيشتر پراكنده ميشود. وقتي به آسمان نگاه ميكنيد، رنگ آبي آسمان همان نور آبي پراكنده شده است.
چرا خورشيد در حال غروب نارنجي مايل به قرمز ديده ميشود؟ وقتي خورشيد در افق است، نسبت به وقتي در بالاي سر شماست، مسير طولانيتري را طي ميكند تا به چشم شما برسد. بيشتر نور آبي خورشيد در هنگام غروب پراكنده ميشود. رنگي كه در نهايت ميبينيد، نارنجي مايل به قرمز است (رنگ نور سفيد منهاي آبي). طول موج نور بنفش حتي از طول موج نور آبي هم كوتاهتر است و بارها بيشتر از نور آبي پراكنده ميشود. پس چرا آسمان بنفش است؟ خورشيد بيشتر نور آبي گسيل ميكند تا بنفش ، بنابراين بيشتر نور پراكنده شده در آسمان آبي است.
منبع:(( وبلاگ شیمی خرامه ))
شعبدهباز در حضور مردم مايعي را در گودي دستش ميريزد. و بيآنكه به آن كبريت بزند، شعله آتش در كف دستش زبانه ميكشد. او در جلو سن قدم ميزند، و بدون احساس ناراحتي با تماشاگران صحبت ميكند، تا مايع تمام شود، و شعله فروكش كند. سپس دستش را با يكدستمال پاك ميكند، و به ادامه برنامهاش ميپردازد. چگونه اين كار ممكن است؟

بقیه در ادامه مطلب ........
دليل اين اتفاق چيست؟
چون نقطه انجماد مايع درون ليوان بالاتر از صفر است، وقتي يخ را كه دماي آن صفر يا زي
ر صفر است را به آن نزديك مي كنيم،به سرعت منجمد مي شود.

منبع:(( وبلاگ شیمی خرامه ))
3 میلی لیترمحلول غلیظ هیدروژن پراکسید را درون یک استوانه مدرج 100 میلی لیتری بریزید . 3 الی 5 قطره صابون مایع به آن بیفزایید . سپس به آرامی 10میلی لیتر محلول غلیظ پتاسیم یدید به آن اضافه کنید . واکنش شروع و کف زرد رنگ زیبایی تولید شده که از درون استوانه به صورت ما رپیچ بیرون می ریزد.
![]()
یون یدید در این واکنش کا تا لیزگر است. یون های- I با سرعت قابل توجهی با مولکول های H2O2 واکنش می دهند و در مرحله بعد یون های IO - حاصل با سرعت بسیار زیادی با مولکول های H2O2 وارد واکنش می شوند .

نرم افزاری که در این جا معرفی می کنیم یک قدم پا را فراتر گذاشته به سراغ رسم ساختارهای هندسی مولکول ها رفته است و کار شما را در رسم ساختارهای شیمیایی در Word بسیار ساده کرده است. به عنوان مثال:

بقیه در ادامه مطلب ........
واکنش ترکیبی
واکنشی است که در آن ، چند ماده با هم ترکیب میشوند و یک یا چند فراورده تازهای با ساختاری پیچیدهتر تولید میکنند. برای نمونه ، واکنش اتم هیدروژن و اکسیژن منجر به تشکیل مولکول آب میشود یا در واکنشهای پلیمریزاسیون که در آنها از تجمع مولکولهای منفرد ، درشتمولکولهایی به نام پلیمر تشکیل میشود.
بقیه در ادامه مطلب ........
برای دانلود کلیک کنید
PL Table 4.50 – Table of Elements یک جدول تناوبی چند منظوره می باشد که شامل بیش از ۲۰ نوع داده برای هر عنصر و ایزوتوپ های عنصر می باشد . نرم افزار همچنین دارای یک موازنه گر بسیار قدرتمند می باشد که قادر معادله های پیچیده آلی را موازنه کند . نرم افزار همچنین قادر است حالات مختلف اکسایش عناصر ، نمایش جدول تناوبی برحسب پارامترهای گوناگون ، قابلیت سفارشی سازی داده ها و … را نمایش دهد.

 رمز فایل :www.iran30t.com
رمز فایل :www.iran30t.com
 منبع : بانک نرم افزار ایران سیتی
منبع : بانک نرم افزار ایران سیتی
برای مشاهده ویدیو آموزشی کلیک کنید

این هم یک ویدیو آموزشی امیدوارم که موجب ضایت خاطر شما بشود.
منبع سایت آپارات